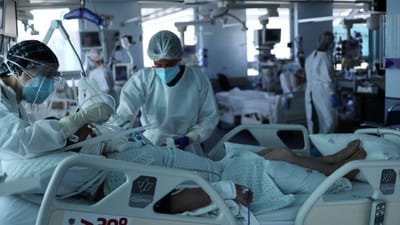
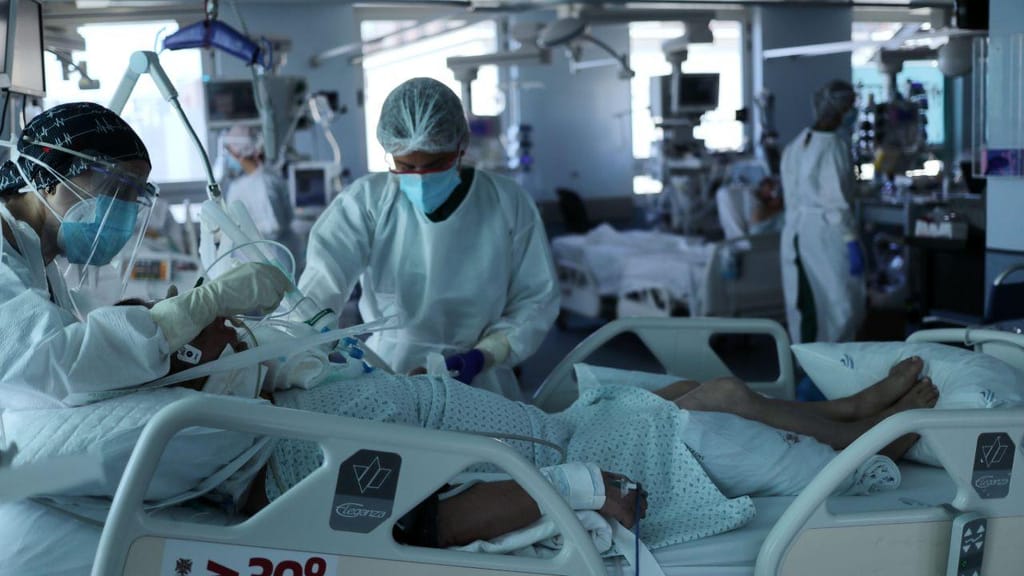
A Agência Europeia do Medicamento (EMA) anunciou esta quinta-feira que está a analisar os dados sobre a utilização do anticorpo monoclonal VIR-7831 no tratamento da covid-19, para apoiar os países na decisão sobre o uso deste medicamento.
A EMA está a iniciar esta revisão para apoiar as autoridades nacionais que podem decidir sobre o uso deste medicamento para a covid-19 antes da sua autorização de introdução no mercado”, adiantou o regulador europeu em comunicado.
Segundo a EMA, esta análise incluirá os dados de um estudo que compara os efeitos deste anticorpo com o de um tratamento simulado (placebo) em doentes infetados com o SARS-CoV-2 com sintomas leves a moderados, mas que apresentavam um alto risco de evolução grave da doença.
Este medicamento foi projetado para se ligar à proteína `spike´ do SARS-CoV-2, limitando a capacidade do vírus de entrar nas células do corpo, e os especialistas da EMA esperam que, desta forma, possa reduzir a necessidade de hospitalização em pessoas infetadas pelo novo coronavírus.
Os resultados preliminares indicam que o VIR-7831 reduziu o risco de hospitalização por mais de 24 horas ou de morte em 85% em comparação com o placebo”, adiantou ainda a EMA.
O Comité de Medicamentos Humanos (CHMP) da EMA vai estudar como o medicamento evita a hospitalização e a morte em pacientes com covid-19 não hospitalizados e que não requerem o uso de oxigénio, assim como os dados sobre a sua qualidade e segurança.
“Embora se preveja o início de uma análise mais abrangente antes de um possível pedido de autorização de introdução no mercado, esta revisão fornecerá recomendações a todas as autoridades nacionais da União Europeia, que, assim, podem tomar decisões baseadas em evidências sobre o uso precoce do medicamento”, explicou a entidade reguladora.